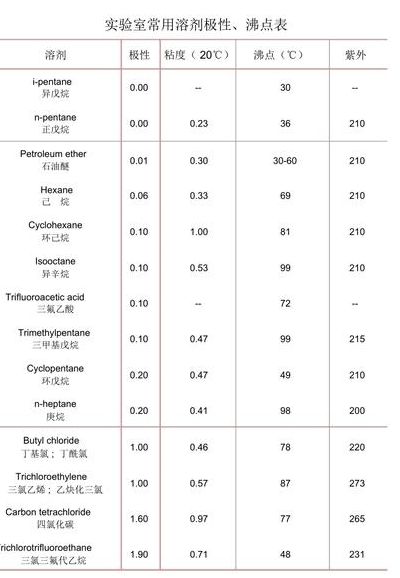
氯化钙不能干燥哪些气体
氯化钙不能干燥乙醇和氨。氨气能与氯化钙发生反应生成氯合物(CaCl2·8NH3),因此不能使用无水氯化钙来干燥氨气。 氯化钙干燥剂主要原料氯化钙是采用优质碳酸钙和盐酸为原料,经反应合成、过滤、蒸发浓缩、干燥等工艺过程精制而成。
然而,氯化钙不能干燥那些能与其反应的气体。例如,它不能干燥二氧化硫(SO2)和二氧化碳(CO2),因为这些气体能与氯化钙发生反应。 此外,氯化钙也不能干燥具有还原性的气体,如硫化氢(H2S),因为这类气体具有氧化性,能与氯化钙发生反应。
中性干燥剂:无水氯化钙,一般气体都能干燥,但无水氯化钙不能干燥氨气和乙醇。碱性干燥剂:碱石灰(CaO与NaOH、KOH的混合物)、生石灰(CaO)、NaOH固体,用于 干燥中性或碱性气体。
乙炔不能用氯化钙干燥的原因是氯化钙对乙炔具有危险性。乙炔是一种极易聚合的气体,其分子中含有三个氢原子和一个碳原子,因此非常不稳定。
无水氯化钙是工业和实验室常用干燥剂,如用于氮气、氧气、氢气、氯化氢、二氧化硫等气体的干燥。不能用来干燥氨、氟气、醇类、胺类、活性酰基化合物、含羰基的化合物。一般只需记住氨气即可。因为发生CaCl+8NH=CaCl·8NH。
酸性干燥剂:浓硫酸、五氧化二磷,用于干燥酸性或中性气体,其中浓硫酸不能干燥硫化氢、溴化氢、碘化氢的强还原性的酸性气体;五氧化二磷不能干燥氨气。中性干燥剂:无水氯化钙,通常气体都能干燥,但无水氯化钙不能干燥氨气和乙醇。
怎样鉴别正戊醇、2-戊酮、3-戊酮和戊醛?
1、正戊醇:可以通过溶解性的变化来鉴别。正戊醇在水中溶解性较好,可以形成透明溶液,而在冷水中溶解度较低,会形成乳白色悬浊液。2-戊酮和3-戊酮:2-戊酮和3-戊酮在水中溶解性较好,可以形成透明溶液。戊醛:戊醛在水中溶解度较低,可能会形成乳白色悬浊液。
2、-丁炔的反应:CH3CH2CH2≡CH —(钠-液氨) CH3CH2CH2≡CNa CH3CH2CH2≡CNa + C7H7Br(苄溴) — CH3CH2CH2≡CC7H7 而2-戊炔不发生与钠-氨发生反应。
3、正戊醇、1-甲基丁醇、2-甲基丁醇、3-甲基丁醇、1-乙基丙醇、2-乙基丙醇、1,1,二甲基丙醇、1,2,二甲基丙醇、2,2,二甲基丙醇、正戊醛、2-甲基丁醛、3-甲基丁醛、2,2,二甲基丙醛、二乙酮(正戊酮)、甲丙酮(1-甲基丁酮)、1,2,二甲基丙酮。
4、丙醇脱水,得丙烯。丙烯与过氧乙酸反应,得环氧丙烷。再水解开环,得2-丙醇。氧化得丙酮。丙酮的αH有酸性,强碱拿掉H形成碳负离子,与溴乙烷反应,得到2-戊酮。2-戊酮还原,得2-戊醇。脱水,得戊烯。戊烯环氧化、水解开环,得正戊醇。CrO3氧化,得到正戊醛。结束。仅供基础有机化学考试。
5、-丁二醇、正丁醇、异丁醇、仲丁醇、叔丁醇、正戊醇、异戊醇、环戊醇、叔戊醇、正己醇、环己醇、4-甲基环己醇、1,6己二醇、正庚醇、正辛醇、正辛醇-异辛醇、糠醇、甲硫醇、乙二硫醇、正丁硫醇、1,3丙二硫醇。
6、对于更为精确的分析,色谱/质谱法也是一种有效手段,同样出自《固体废弃物试验与分析评价手册》,在环境标准上,前苏联对车间空气中的有害物质设置了严格的最高容许浓度,即1毫克每立方米。此外,嗅觉阈浓度也被设定为8 parts per million (ppm),这是判断空气中是否存在该物质的重要指标。
正戊醇萃取时静置后分层,以及再用盐酸萃取+时静置后分层,分别收集哪一...
1、综上所述,当正戊醇萃取时静置后分层,我们通常收集位于上层的正戊醇层样液;而当再用盐酸萃取时静置后分层,我们则收集沉淀物较多的底部样液。需要注意的是,这些只是一般的指导原则,实际操作中可能需要根据具体的实验条件和目的进行微调。此外,无论在何种情况下,都应确保实验操作的安全性。
正戊酸和异戊酸有什么区别?区别在于哪里?
正戊酸和异戊酸的主要区别在于它们的分子结构、性质和用途上。正戊酸(化学式C5H10O2,结构式CH3(CH2)3COOH)是一种无色透明液体,具有腐败气味,相对密度较大,熔点较低,主要用于有机合成和制备戊酸酯类,还可用于香料、增塑剂和药物等领域。制取方法包括电解氧化正戊醇和蒸馏缬草。
异戊酸,又称3-甲基丁酸或异丙基乙酸,分子式C3H10O2,结构式为(CH4)2CHCH2COOH。它是一种无色透明液体,气味强烈但经过稀释后会散发出甜润的果香,带有笃斯越橘样的香味。其相对密度为0.9286(20℃),沸点177℃,熔点为-23℃,折射率4043(20℃),在缬草、蛇麻草油和烟草中可以找到。
正戊酸低毒,皮肤触及时应立即用水冲洗。异戊酸的性能及用途 异戊酸,又称3-甲基丁酸、异丙基乙酸、异穿心排草酸,化学式为C3H10O2,结构式为(CH4)2CHCH2COOH。
物质的浓度与ph值的关系
1、水中氨氮的浓度高低确实会对水的pH值产生一定的影响,因为氨氮与水形成弱碱性物质。当氨氮浓度较高时,水的pH值会相应增大。具体而言,氨氮浓度在500~2200mg/L范围内,pH值可从5升至5。
2、pH与酸浓度之间的换算关系为pH=-lgCH。举例来说,当pH为5时,通过公式计算可得酸浓度CH为0.03162mol/l。进一步说明,假设有一升溶液,其酸浓度为0.03162mol/l。这意味着溶液中含有的H离子数量为0.03162mol。根据摩尔质量计算,这相当于0.03162g的H离子质量。
3、的浓度积是定值,即10-14,叫做水的电离常数(Kw)。Ph值相等是指溶质在水中电离出的氢离子浓度相同还要分辨是否是弱电解质然而物质的量浓度 相等是指同体积溶液中 溶液中溶质的物质的量相等。
4、不一定。如果是酸,碱,强酸弱碱盐,强碱弱酸盐的溶液,浓度越高,酸碱性越强 但如果是中性的盐溶液或者其他中性物质的溶液,其PH值与溶液浓度无关。