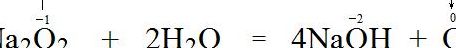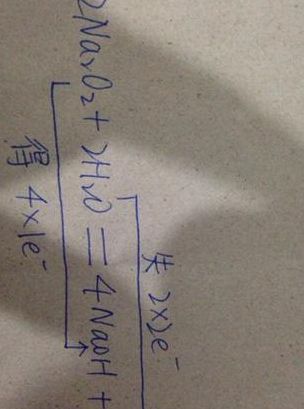过氧化钠与水反应的化学方程式
Na2O+H2O==2NaOH。作为碱性氧化物,Na2O与水反应生成相应的碱(Na2O+H2O=2NaOH)。Na2O2也可以与水反应,不过生成物不只是相应的碱,还有氧气。往反应后的溶液中滴加酚酞,溶液显红色,但很快红色就会褪去,这主要是因为过氧根的强氧化性,具有漂白作用(反应中间生成的过氧化氢的作用)。
过氧化钠和水反应的化学方程式 (1) 化学方程式:2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2H2O=4NaOH+O2↑。(2) 离子方程式:2Na2O2+2H2O=4Na++4OH+O2↑2Na2O2+2H2O=4Na++4OH+O2↑。
反应的化学方程式为:2Na2O2+2H2O=4NaOH++ O2↑,其中过氧化钠中-1价的氧原子一个升高到0价,一个降低到-2价。即,过氧化钠既做氧化剂又做还原剂。
过氧化钠和水反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑。分析:过氧化钠与水反应,生成氢氧化钠和氧气。过氧化钠为白至淡黄色的粉末状固体,易吸潮,溶于乙醇、水过和酸(本质是与其发生反应),难溶于碱。过氧化钠的应用领域:过氧化钠可用于医药、印染、漂白及用作分析试剂等。
过氧化钠与水反应的化学方程式为:2NaO+ 2HO = 4NaOH +O↑。实际的反应是过氧化钠首先和水反应生成氢氧化钠和双氧水,反应的方程式:NaO+2HO=2NaOH+HO。
过氧化钠和水反应的化学方程式是什么?
1、过氧化钠和水反应的化学方程式 (1) 化学方程式:2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2H2O=4NaOH+O2↑。(2) 离子方程式:2Na2O2+2H2O=4Na++4OH+O2↑2Na2O2+2H2O=4Na++4OH+O2↑。
2、过氧化钠和水反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑。分析:过氧化钠与水反应,生成氢氧化钠和氧气。过氧化钠为白至淡黄色的粉末状固体,易吸潮,溶于乙醇、水过和酸(本质是与其发生反应),难溶于碱。过氧化钠的应用领域:过氧化钠可用于医药、印染、漂白及用作分析试剂等。
3、反应的化学方程式为:2Na2O2+2H2O=4NaOH++ O2↑,其中过氧化钠中-1价的氧原子一个升高到0价,一个降低到-2价。即,过氧化钠既做氧化剂又做还原剂。
4、过氧化钠与水反应的化学方程式为:2NaO+ 2HO = 4NaOH +O↑。实际的反应是过氧化钠首先和水反应生成氢氧化钠和双氧水,反应的方程式:NaO+2HO=2NaOH+HO。
na2o2与水反应是什么?
1、na2o2与水反应是:第一步:Na2O2与水发生复分解反应,原理:Na2O2+2H2O=H2O2+2NaOH。第二步:H2O2分解生成H2O和O2,原理:2H2O2=2H2O+O2↑。总反应式:2Na2O2+2H2O=4NaOH+O2↑。过氧化钠可用于医药、印染、漂白及用作分析试剂等。用作分析试剂,如用作分解样品的碱性氧化性溶剂。
2、过氧化钠和水反应是一种化学反应,其中过氧化钠(Na2O2)与水(H2O)发生反应,生成氢氧化钠(NaOH)和氧气(O2)。在反应中,过氧化钠分解为两个钠离子(Na+)和一个过氧根离子(O2-)。水分子中的氢离子(H+)与过氧根离子结合形成氢氧根离子(OH-)。
3、过氧化钠和水反应的化学方程式是:2Na2O2+2H2O=4NaOH+O2↑。过氧化钠和水反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑。过氧化钠,是一种无机化合物,化学式为Na2O2,为米黄色粉末或颗粒。加热至460℃时分解。在空气中迅速吸收水分和二氧化碳。与有机物接触会导致燃烧或爆炸,应密闭保存。
4、O实验现象:有大量气泡产生 解释和结论:往滴有酚酞的水中放入钠 钠和水剧烈反应 水会变成红色 说明有碱生产。过氧化钠为白至淡黄色的粉末状固体,易吸潮,溶于乙醇、水和酸(本质是与其发生反应),难溶于碱 过氧化钠还具有漂白性,原因是过氧化钠与水反应过程中会生成过氧化氢。
过氧化钠与水反应过氧化钠做什么剂
反应的化学方程式为:2Na2O2+2H2O=4NaOH++ O2↑,其中过氧化钠中-1价的氧原子一个升高到0价,一个降低到-2价。即,过氧化钠既做氧化剂又做还原剂。
反应方程式为2Na2O2+2H2O==4NaOH+O2↑,发现过氧化钠中的氧在反应前后化合价是既生既降,所以过氧化钠是既做氧化剂也做还原剂。
过氧化钠与水发生反应,生成氢氧化钠、水和二氧化碳。反应方程式:2Na2O2 + 2H2O = 4NaOH + O2↑ 氧化剂:过氧化钠 还原剂:过氧化钠 这是一个歧化反应,过氧化钠即是氧化剂,又是还原剂。在氧化还原反应中 氧化剂:得电子的物质,化合价降低。还原剂:失电子的物质,化合价升高。
元素化合价降低的是氧化剂,升高的是还原剂。过氧化钠里面的2个O原子从-1价升高到0价,是还原剂。2个O原子从-1价降低到-2价,是还原剂。所以,过氧化钠既是氧化剂又是还原剂。
过氧化钠和水反应生成什么?
1、过氧化钠 与水的反应放出的热,使生成的过氧化氢分解为氧气和水。
2、分析:过氧化钠与水反应,生成氢氧化钠和氧气。过氧化钠为白至淡黄色的粉末状固体,易吸潮,溶于乙醇、水过和酸(本质是与其发生反应),难溶于碱。过氧化钠的应用领域:过氧化钠可用于医药、印染、漂白及用作分析试剂等。用作分析试剂,如用作分解样品的碱性氧化性溶剂。
3、Na2O+H2O==2NaOH。作为碱性氧化物,Na2O与水反应生成相应的碱(Na2O+H2O=2NaOH)。Na2O2也可以与水反应,不过生成物不只是相应的碱,还有氧气。往反应后的溶液中滴加酚酞,溶液显红色,但很快红色就会褪去,这主要是因为过氧根的强氧化性,具有漂白作用(反应中间生成的过氧化氢的作用)。
4、过氧化钠和水反应是生成 氢氧化钠和氧气,反应式如下2Na2O2 + 2H2O = 4NaOH + O2↑可以理解为,先与水发生复分解反应生成过氧化氢和氢氧化钠,其后过氧化氢在碱的催化下生成氧气。
5、过氧化钠与水反应的化学方程式为:2NaO+ 2HO = 4NaOH +O↑。实际的反应是过氧化钠首先和水反应生成氢氧化钠和双氧水,反应的方程式:NaO+2HO=2NaOH+HO。
6、过氧化钠和水的反应首先产生过氧化氢,其原因是它们先以离子状态运动,并相互接触而发生反应,然后才是氧化还原反应。