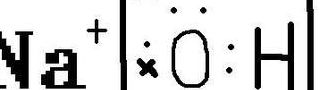
氢氧化钠的电子式怎么写?
氢氧化钠的电子式如图所示:氢氧化钠的性质:氢氧化钠具有强碱性与吸湿性。易溶于水,溶解时放热,水溶液呈碱性。腐蚀性极强,对纤维、皮肤、玻璃、陶瓷等有腐蚀作用。与金属铝和锌、非金属硼和硅等反应放出氢;与氯、溴、碘等卤素发生歧化反应;与酸类起中和作用而生成盐和水。
氢氧化钠的电子式可以这样书写:先写阳离子:钠离子是氢氧化钠的阳离子部分。在电子式中,我们简单地用Na来表示。再写阴离子:氢氧根离子是氢氧化钠的阴离子部分。在书写电子式时,需要注意氧原子和氢原子之间的共价键。
Na+(OH)-。氢氧化钠NaOH是离子化合物,钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键。因此,氢氧化钠电子式的书写为:Na+(OH)-。
请问氢氧化钠的电子式怎么写?
氢氧化钠的电子式如图所示:氢氧化钠的性质:氢氧化钠具有强碱性与吸湿性。易溶于水,溶解时放热,水溶液呈碱性。腐蚀性极强,对纤维、皮肤、玻璃、陶瓷等有腐蚀作用。与金属铝和锌、非金属硼和硅等反应放出氢;与氯、溴、碘等卤素发生歧化反应;与酸类起中和作用而生成盐和水。
氢氧化钠的电子式如下:氢氧化钠的化学式是NaOH,氢氧化钠具有强碱性,腐蚀性极强,可作酸中和剂、 配合掩蔽剂、 沉淀剂、沉淀掩蔽剂、显色剂、皂化剂、去皮剂、洗涤剂等,用途非常广泛。工业生产氢氧化钠的方法有苛化法和电解法两种。
氢氧化钠的电子式为Na+[:OH]-,表示钠离子和氢氧根离子通过得失电子结合在一起,形成离子键。氢氧化钠,化学式为NaOH,俗称烧碱、火碱、苛性钠,是一种具有强腐蚀性的强碱,一般为片状和块状形态,易溶于水。
氢氧化钠的形成过程电子式:2Na-2(e-)→2Na+ 2H2O+2(e-)→OH-+H2↑ 氢氧化钠,化学式为NaOH,为一种具有强腐蚀性的强碱,一般为片状或块状形态,易溶于水(溶于水时放热)并形成碱性溶液,另有潮解性,易吸取空气中的水蒸气(潮解)和二氧化碳(变质),可加入盐酸检验是否变质。
Na+(OH)-。氢氧化钠NaOH是离子化合物,钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键。因此,氢氧化钠电子式的书写为:Na+(OH)-。
氢氧化钠的形成过程电子式是什么?
氢氧化钠的形成过程电子式:2Na-2(e-)→2Na+ 2H2O+2(e-)→OH-+H2↑ 氢氧化钠,化学式为NaOH,为一种具有强腐蚀性的强碱,一般为片状或块状形态,易溶于水(溶于水时放热)并形成碱性溶液,另有潮解性,易吸取空气中的水蒸气(潮解)和二氧化碳(变质),可加入盐酸检验是否变质。
氢氧化钠的形成过程可以分为苛化法、电解法,其电子式表示如下:苛化法:Na2CO3+Ca(OH)2→2NaOH+CaCO3↓ Na2CO3+Ca(OH)2→2NaOH+CaCO3↓ , NaHCO3+Ca(OH)2→NaOH+CaCO3↓+H2O。电解法:2NaCl+2H2O[电解]→2NaOH+Cl2↑+H2↑。2NaCl+2H2O→2NaOH+H2↑+Cl2↑。
氢氧化钠的电子式如图所示:氢氧化钠的性质:氢氧化钠具有强碱性与吸湿性。易溶于水,溶解时放热,水溶液呈碱性。腐蚀性极强,对纤维、皮肤、玻璃、陶瓷等有腐蚀作用。与金属铝和锌、非金属硼和硅等反应放出氢;与氯、溴、碘等卤素发生歧化反应;与酸类起中和作用而生成盐和水。
能。氢氧化钠的形成过程电子式:2Na-2(e-)-2Na+2H2O+2(e-)-OH-+H2↑。氢氧化钠,也称苛性钠、烧碱、火碱,是一种无机化合物,化学式NaOH,氢氧化钠具有强碱性,腐蚀性极强,可作酸中和剂、配合掩蔽剂、沉淀剂、沉淀掩蔽剂、显色剂、皂化剂、去皮剂、洗涤剂等。
氢氧化钠的电子式为Na+[:OH]-,表示钠离子和氢氧根离子通过得失电子结合在一起,形成离子键。氢氧化钠,化学式为NaOH,俗称烧碱、火碱、苛性钠,是一种具有强腐蚀性的强碱,一般为片状和块状形态,易溶于水。
氢氧化钠的电子式为Na+[:O:H]-。具体来说,Na+代表钠离子,而[:O:H]-则代表氢氧根离子。在这个电子式中,氧原子周围有8个电子,氢原子则有2个电子。氢氧原子间以共价键连接。这样的表示方式只适用于主族元素形成的物质,并不适用于过渡元素形成的物质。