为什么氧化还原反应的电极电势是不断变化的?
1、氧化型物质浓度增加,电极电位增大,氧化能力增强;还原型物质浓度增加,电极电位降低,还原物质的还原能力增强,氧化型物质的氧化能力下降。氧化还原反应是在反应前后元素的氧化数具有相应的升降变化的化学反应。
2、浓度对电极电势和氧化还原反应的影响:当氧化态物质的浓度增大或还原态物质的浓度减小时,电极电势升高,氧化态物质在水溶液中的氧化能力增强,还原态物质的还原能力降低。
3、氧化还原与电极电势的关系如下:氧化还原反应总是由较强的氧化剂与还原剂向着生成较弱的氧化剂和还原剂方向进行。从电极电势的数值来看,当氧化剂电对的电势大于还原剂电对的电势时,反应才可以进行。
4、电极电势是由于金属与溶液中的离子发生氧化还原反应而产生的电势。
5、在氧化还原反应中,电极电位产生的原因是电子得失或转移 ,而膜电位的产生是由于溶液和膜界面发生了离子交换和离子扩散。
6、通常条件下,氧化还原反应总是由较强的氧化剂与还原剂向着生成较弱的氧化剂和还原剂方向进行。从电极电势的数值来看,当氧化剂电对的电势大于还原剂电对的电势时,反应才可以进行。
氧化电势和还原电势是一正一负吗
1、还原电势与负氧化电势不是完全相等的,但它们之间存在一定的关系。还原电势是指在标准状态下,一个化学物质被还原为它的基态的过程中所释放或吸收的电子数所对应的电势,它通常用 E° 表示。
2、在一般应用中,氧化还原电位和电极电势两个名词混用。氧化还原电位越负,越倾向于发生氧化反应;氧化还原电位越正,越倾向于发生还原反应。
3、在一般应用中,氧化还原电位和电极电势两个名词混用。 氧化还原电位越负,越倾向于发生氧化反应;氧化还原电位越正,越倾向于发生还原反应。
4、您对这个例子的观察是正确的。根据标准电极电势的定义,正电极电势越大,表示该物种越容易被还原,即具有更强的还原性。相反,负电极电势越大,表示该物种越容易被氧化,即具有更强的氧化性。
5、(l)一般采用电极反应的还原电势,每一电极的电极反应均写成还原反应形式,即:氧化型 + ne = 还原型,(2)标准电极电势是平衡电势,每个电对E值的正负号,不随电极反应进行的方向而改变。
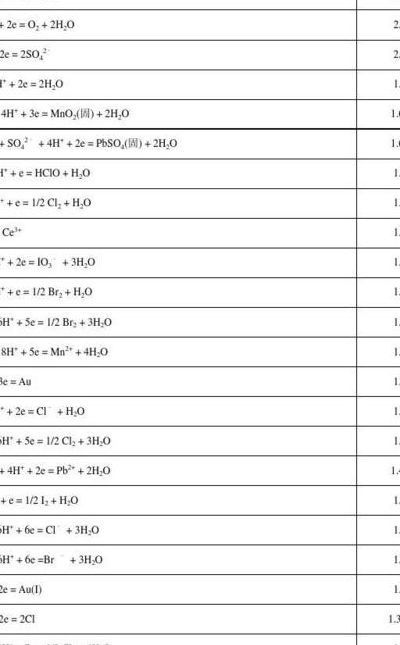
氧化还原点对标准电极电势怎样比较大小
1、E值越小(例如Li:-03v)的电极其还原型物质愈易失去电子,是愈强的还原剂,对应的氧化型物质则愈难得到电子,是愈弱的氧化剂。
2、至于氧化性与还原性,有一下规律:标准电极电势越高,其氧化态的氧化性越强;反之,其还原态的还原性越强。
3、实际上就是比氧化性,标准状况下氧化性大的标准电极电势大。Br2Fe3+Fe2+Br-。学好化学:课堂笔记。课堂笔记是认真听讲的一种表现形式。
4、根据标准电极电势的大小来判定 一个电对的标准电极电势值越正,该电对中的氧化性物种的氧化性越强 一个电对的标准电极电势值越负,那么该电对中的还原性物种的还原能力越强。
氧化还原反应中是不是电极电势差越大,反应
1、电极电势差是热力学性质,只能用来表示反应倾向的大小; 反应速率的快慢是动力学性质。
2、据电势差判断,氧化还原反应电势差越大越容易反应,即氧化性物质被还原的电势越高还原态被氧化电对的电势越低越容易反应。所以超电势越高反应越容易发生。
3、反应的EO是热力学问题,而快慢是动力学问题,两者并无关系,故EO值相差大小与快慢无关。
4、不一定,电极电势差值越大只能说明二者越容易反应。反应速率的快慢还要看反应条件和外界影响。电极电势是电化学和热力学影响的总和,决定能不能反应。反应速率是动力学条件影响的结果,决定这个反应有没有实际价值。
5、化学反应必须是氧化还原反应,两极上发生氧化还原反应,产生电极电位,即产生电极电势,从而产生电流。